Ύδωρ
Water, Νερό


Δύση
Σταγονίδιο
It is easy to see that
the drop seems to have a "skin" holding it
into a sort of flattened sphere.
It turns out that this surface tension
is the result of the tendency of water molecules
to attract one another (called cohesion).
Adhesion and cohesion are important water properties
that affects how water works everywhere,
from plant leaves to your own body.
Just remember,
Cohesion: Water is attracted to water, and
Adhesion: Water is attracted to other substances.
The kinetic energy of the molecules
results in random motion
, causing diffusion
. In simple diffusion, this process proceeds
without the aid of a transport protein.
it is the random motion of the molecules
that causes them to move from
an area of high concentration to
an area with a lower concentration.
Because, they have what Orb,
scientists call round or rolling molecules,
and thus why liquids run until
they find their own level
in Nature's equilibrium.

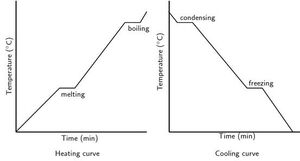
Πήξη
Βρασμός
Τήξη
συμπύκνωση
Ύδωρ
Ύδωρ
Εξάτμιση
Κατακρήμνιση
Συμπύκνωση
Εξάτμιση
Διαπνοή
Κατακρήμνιση
χώμα
αέρας
πυρ
ύδωρ
ψύχος
καύμα
ξηρασία
υγρασία

Βιολογία

Αταξία
Χλωριούχο Νάτριο
Ύδωρ
- Mία Χημική Ένωση.
Ετυμολογία[]
Η ονομασία "ύδωρ" σχετίζεται ετυμολογικά με την λέξη "[[]]".
Εισαγωγή[]
Το νερό (ή στη καθαρεύουσα ύδωρ, λέξη απο την οποία και πολλοί οι παράγωγοι όροι) είναι μια πολύ διαδεδομένη Χημική Ουσία που είναι απαραίτητη σε όλες τις γνωστές μορφές ζωής στον πλανήτη μας . Οι άνθρωποι και τα ζώα έχουν στο σώμα τους 60-70% νερό. Το νερό αποτελείται από υδρογόνο και οξυγόνο.
Καταστάσεις[]

Θαλασσινό Νερό, το κυρίαρχο συστατικό της Γήινης επιφάνειας
Απαντάται σε τρεις μορφές:
- στερεή (πάγος, χιόνι),
- υγρή (νερό πηγών, ποταμών, θαλασσών) και
- αέρια (υδρατμοί στην ατμόσφαιρα).
Επίσης, το νερό υπάρχει σ' όλους τους ζωντανούς (ζωικούς και φυτικούς) οργανισμούς.
Στις τροφές υπάρχει σε μεγάλο ποσοστό.
Στο Ανθρώπινο Σώμα το νερό περιέχεται σε ποσότητα 70% και στο αίμα 90%.
Μερικές φορές προσκολλάται σε διάφορες χημικές ουσίες και σχηματίζει με αυτές ένυδρες ενώσεις, συνήθως κρυσταλλικές, όπως είναι:
- ο ένυδρος Θειικός Χαλκός,
- ο γύψος,
- το Θειικό Ασβέστιο κ.ά.
Το νερό αυτό ονομάζεται "κρυσταλλικό νερό". Άλλοτε πάλι το νερό ενώνεται σταθερά με τα μόρια των χημικών ενώσεων και σχηματίζεται νέα χημική ένωση. Έτσι π.χ. το τριοξείδιο του θείου και το πεντοξείδιο του φωσφόρου ενώνονται με το νερό και δίνουν νέες χημικές ενώσεις, το Θειικό Οξύ και το Φωσφορικό Οξύ.
Το νερό αυτό ονομάζεται "χημικό" και δεν είναι δυνατό να απομακρυνθεί με θέρμανση όπως το κρυσταλλικό νερό.
Σύσταση[]
Το ύδωρ μέχρι το 18ο αιώνα θεωρούνταν ως Χημικό Στοιχείο.
Πρώτος ο πατέρας της νεότερης Χημείας Λαβουαζιέ απέδειξε ότι είναι ένωση του υδρογόνου και του οξυγόνου. Κάθε μόριο νερού περιέχει δύο άτομα υδρογόνου και ένα άτομο οξυγόνου. Έτσι ο χημικός τύπος του νερού είναι H2O και η σχετική αναλογία βαρών του υδρογόνου και του οξυγόνου είναι 2,016: 16,000.
Δομή του μορίου[]
| Γενικές | |
|---|---|
| Ονομασία | Ύδωρ |
| Μοριακή Γεωμετρία (non-SI) | Διάγραμμα ενός μορίου νερού, με τις διαστάσεις του |
| Χημικός Τύπος | H2O |
| εμφάνιση | Διαυγές, σχεδόν άχρωμο υγρό με έναν ελαφρά μπλε τόνο [1]. |
| Φυσικές | |
| Ατομικό Βάρος | 18.01528 amu |
| Σημείο Τήξεως | 273.15 K (0 °C) |
| Σημείο Ζέσεως | 373.15 K (100 °C) |
| Κρίσιμη Θερμοκρασία | 647 K |
| Κρίσιμη πίεση | 22.1 MPa |
| Πυκνότητα (μεγ.) | 999.972 kg/m3 στους 4 °C |
| Δείκτης Διάθλασης | 1.333 (υγρό νερό, 20 °C) |
| Θερμοχημεία | |
| ΔfH0αέριο | -241.83 kJ/mol |
| ΔfH0υγρό | -285.83 kJ/mol |
| ΔfH0στερεό | -291.83 kJ/mol |
| S0αέριο, 1 bar | 188.84 J/(mol·K) |
| S0υγρό, 1 bar | 69.95 J/(mol·K) |
| S0στερεό | 41 J/(mol·K) |
| Ασφάλεια | |
| Κατάποση | Απαραίτητο για τη συντήρηση της ζωής. Υπερβολική κατανάλωση μπορεί να προκαλέσει κράμπες, και μπορεί να οδηγήσει τελικά σε ανισορροπία ηλεκτρολυτών εξαιτίας της όσμωσης, προκαλώντας πονοκέφαλο, σύγχυση και πιθανόν κώμα ή θάνατο (μετά από ώρες). |
| Εισπνοή | Μπορεί να οδηγήσει σε ασφυκτικά συμπτώματα παρ' όλιγον πνιγμό ή ημιπνιγμό και πνιγμό. |
| Επιδερμίδα | Παρατεταμένη εμβάπτιση (παραμονή στο νερό) μπορεί να προκαλέσει ξεφλούδισμα (απολέπιση). |
| οφθαλμοί | Δεν ενέχει κίνδυνο. |
|
Μονάδες SI χρησιμοποιήθηκαν όπου ήταν δυνατό. Εκτός αν αναφέρεται διαφορετικά, τα μεγέθη αναφέρονται σε κανονικές συνθήκες.
| |
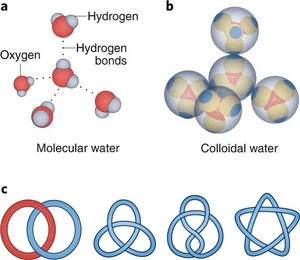
Το μόριο του νερού δεν είναι γραμμικό, δηλαδή οι δεσμοί Ο-Η δε βρίσκονται πάνω στην ίδια ευθεία, αλλά σχηματίζουν γωνία 104,5 μοιρών. Το μήκος του δεσμού Ο-Η είναι 0,96 Å (Άγκστρεμ, 1 Å = 10-8 cm). Λόγω της γωνιακής διάταξης του δεσμού Ο-Η, το μόριο του νερού είναι ασύμμετρο και έχει υψηλή Διπολική Ροπή. Το κέντρο του θετικού φορτίου βρίσκεται προς την πλευρά του υδρογόνου και του αρνητικού προς την πλευρά του οξυγόνου. Ο υψηλός πολικός χαρακτήρας του μορίου εξηγεί τη μεγάλη του διηλεκτρική σταθερά (78 στους 25°C) και άλλες ιδιότητες αυτού, όπως είναι η διάλυση ετεροπολικών ενώσεων στο νερό, ιδιότητα που το καθιστά ένα από τα καλύτερα διαλυτικά μέσα.
Το νερό παρουσιάζει έντονα το φαινόμενο της σύζευξης, με τη δημιουργία δεσμών διά γέφυρας υδρογόνου. Τα μόρια δηλαδή του νερού σχηματίζουν δεσμούς μεταξύ του ηλεκτροθετικού υδρογόνου του ενός μορίου και του ηλεκτροαρνητικού οξυγόνου του άλλου μορίου.
Δεσμοί υδρογόνου μεταξύ των μορίων του νερού εξακολουθούν να υπάρχουν και σε υψηλή σχετικά θερμοκρασία. Έτσι, στους 25°C ο αριθμός των δεσμών υδρογόνου μεταξύ των μορίων του νερού έχει τέτοια τιμή, ώστε ο στοιχειομετρικός τύπος του, στους 25°C, δεν είναι ο γνωστός H2O, αλλά H180O90.
Φυσικές ιδιότητες[]
Το ύδωρ είναι υγρό, διαυγές, άχρωμο σε λεπτά στρώματα, κυανίζον σε μεγάλους όγκους. Η καθαρή ουσία είναι άγευστη, ενώ το καλό πόσιμο νερό έχει ευχάριστη γεύση, που οφείλεται στα διαλυμένα άλατα και αέρια.
Η πυκνότητα του νερού είναι διαφορετική σε διάφορες θερμοκρασίες, με μέγιστη στους 4°C.
Στον παρακάτω πίνακα δίνονται οι τιμές της πυκνότητας του νερού σε διάφορες θερμοκρασίες.
| ΠΥΚΝΟΤΗΤΕΣ ΝΕΡΟΥ ΚΑΙ ΠΑΓΟΥ | |
|---|---|
| Θερμοκρασία σε °C | Πυκνότητα (gr/cm3) |
| 100 | 0.9586 |
| 80 | 0.9719 |
| 60 | 0.9833 |
| 40 | 0.9923 |
| 20 | 0.9982 |
| 10 | 0.9997 |
| 5 | 0.9999 |
| 3.98 | 1.0000 |
| 0 (νερό) | 0.9998 |
| 0 (πάγος) | 0.9170 |
Από τον πίνακα φαίνεται ότι το ύδωρ σε στερεή κατάσταση έχει μικρότερη πυκνότητα από ό,τι στην υγρή. Αυτό έχει μεγάλη σημασία για την οικονομία της Φύσης:
Οι πάγοι επιπλέουν στο ύδωρ και δρουν ως μονωτικά, εμποδίζοντας το ύδωρ που βρίσκεται από κάτω να παγώσει, με όλες τις ευεργετικές συνέπειες στη ζωή του υδρόβιου κόσμου. Χωρίς την "ανωμαλία" αυτή της πυκνότητας του ύδατος, η ζωή στον πλανήτη μας δεν θα υπήρχε, τουλάχιστον με τη σημερινή της μορφή, εξ αιτίας της βαθμιαίας ψύξης του ύδατος της επιφάνειας της Γης. Η ιδιορρυθμία της πυκνότητας του ύδατος είναι η αιτία της αποσάθρωσης των βράχων. Το ύδωρ που εισέρχεται στις ρωγμές των βράχων στερεοποιείται κατά τη διάρκεια του χειμώνα και προκαλεί την αποσάθρωσή τους. Επιπλέον, η ρήξη των σωλήνων διανομής του ύδατος κατά το χειμώνα οφείλεται στην αύξηση του όγκου του ύδατος κατά τη μετάβαση από την υγρή στη στερεή κατάσταση.
Το ύδωρ έχει Ειδική Θερμότητα (θερμοχωρητικότητα) πολύ μεγάλη (). Χρησιμοποιείται ευρύτατα ως ψυκτικό μέσο και ως φορέας θερμότητας στα καλοριφέρ.
Χημικές ιδιότητες[]
Το νερό έχει ποικίλη χημική δράση. Σχηματίζει "ενώσεις διά προσθήκης" με πολλά άλατα, καθώς και με πολλά μόρια άλλων ουσιών. Οι ενώσεις αυτές ονομάζονται υδρίτες ή ένυδρες ενώσεις. Οι δυνάμεις που ενώνουν τα μόρια των ουσιών και του ύδατος είναι:
- Ελκτικές δυνάμεις μεταξύ του θετικού ιόντος του μετάλλου και του αρνητικού οξυγόνου του πεπολωμένου μορίου του ύδατος
- Σχηματισμός ημιπολικού δεσμού μεταξύ του ατόμου του οξυγόνου και του ιόντος του μετάλλου με ένα ζεύγος ηλεκτρονίων.
- Σχηματισμός γέφυρας υδρογόνου μεταξύ του μορίου του νερού και της ουσίας.
Άλλος σημαντικός τύπος αντίδρασης του νερού είναι η υδρόλυση.
Το ύδωρ επιτελεί αντιδράσεις οξειδοαναγωγής, όπου δρα άλλοτε ως οξειδωτικό και άλλοτε ως αναγωγικό μέσο.
Βαρύ και Υπερβαρύ Ύδωρ[]
Εκτός από το συνηθισμένο ύδωρ (Η2Ο), που είναι το οξείδιο του πρωτίου (H), έχουμε και το βαρύ ύδωρ, που είναι το οξείδιο του δευτερίου (D2Ο), καθώς και το υπερβαρύ ύδωρ, που είναι το οξείδιο του τριτίου (Τ2Ο). Βρέθηκε ότι στο φυσικό νερό περιέχεται το D2Ο (βαρύ ύδωρ) σε ποσότητα 1:6.000 περίπου. Καθαρό D2Ο παρασκευάζεται με εξαντλητική ηλεκτρόλυση υδατικών διαλυμάτων αλκαλίων, επειδή ηλεκτρολύεται κατά προτίμηση το κοινό ύδωρ και συνεπώς, τα υπολείμματα της ηλεκτρόλυσης του ύδατος εμπλουτίζονται σε βαρύ ύδωρ.
Φυσικό Ύδωρ[]
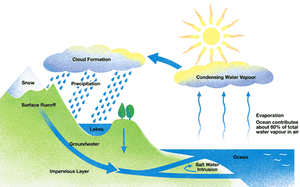
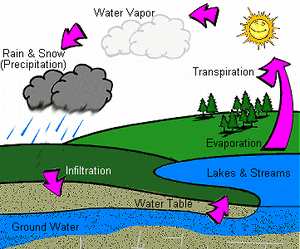
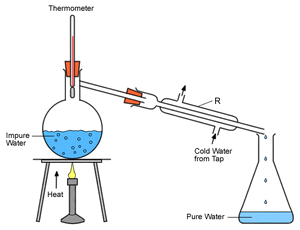
Το φυσικό ύδωρ (πηγών, ποταμών κ.λ.π.) δεν είναι καθαρή χημική ένωση. Περιέχει σχεδόν πάντοτε διαλυμένα ανόργανα άλατα, αέρια και άλλες ουσίες, πολλές φορές και οργανικές. Σχηματίζεται από τη συμπύκνωση των υδρατμών που παράγονται από την εξάτμιση του ύδατος των ποταμών, των λιμνών και των θαλασσών που πίπτει ως βροχή, χιόνα ή χάλαζα.
Η ανακύκλωση του νερού του πλανήτη μέσω συνεχών μετατροπών στη φυσική του κατάσταση είναι γνωστή και ως υδρολογικός κύκλος
Το ύδωρ της βροχής διαλύει διάφορα συστατικά της ατμόσφαιρας, π.χ.
- διοξείδιο του άνθρακα (CΟ2),
- λίγο οξυγόνο και
- άζωτο,
συμπαρασύρει σκόνη, αιθάλη και άλλες αιωρούμενες ουσίες.
Φθάνει στη γη ως αραιότατο οξύ, λόγω του διαλυμένου διοξειδίου του άνθρακα. Για το λόγο αυτόν, το φυσικό ύδωρ διαλύει τα δυσδιάλυτα ανθρακικά άλατα του ασβεστίου και του μαγνησίου και τα μετατρέπει σε ευδιάλυτα όξινα ανθρακικά άλατα των στοιχείων.
Άλατα και αποσκλήρυνση[]
Όλα σχεδόν τα πόσιμα νερά περιέχουν, εκτός από τα όξινα ανθρακικά άλατα, και άλλα που διαλύονται στο ύδωρ, όταν αυτό τα συναντά στο έδαφος, όπως:
- Χλωριούχο Νάτριο (ΝaCl),
- Θειϊκό Ασβέστιο (CaSΟ4),
- Θειϊκό Μαγνήσιο (ΜgSΟ4) κ.λ.π.
Όταν το ύδωρ περιέχει μεγάλη ποσότητα διαλυμένων αλάτων, λέγεται σκληρό νερό. Το σκληρό ύδωρ είναι ακατάλληλο για την πλύση με σάπωνα, επειδή σχηματίζονται σε αυτό αδιάλυτοι σάπωνες ασβεστίου και μαγνησίου, δηλ. ελαϊκά, παλμιτικά και στεατικά άλατα ασβεστίου και μαγνησίου που δεν έχουν καμία απορρυπαντική ικανότητα και επιπλέον δεν σχηματίζεται καθόλου αφρός σάπωνα.
Το σκληρό νύδωρ προκαλεί διάφορες σοβαρές βιομηχανικές ενοχλήσεις στους ατμολέβητες και αφήνει μετά την εξάτμιση σημαντικές ποσότητες στερεών αποθεμάτων (πουρί).
Παλαιότερα, η αποσκλήρυνση του ύδατος, η αφαίρεση δηλαδή των όξινων ανθρακικών αλάτων του ασβεστίου και του μαγνησίου, γινόταν χημικώς, αναμειγνύοντας και αναταράζοντας το ύδωρ με γάλα ασβέστου. Μετά την ανατάραξη κατακαθόταν το ευδιάλυτο όξινο ανθρακικό ασβέστιο ως αδιάλυτο ανθρακικό ασβέστιο. Αφηνόταν να καταπέσει το στερεό ανθρακικό ασβέστιο (CaCΟ3) και λαμβανόταν το διαυγές ύδωρ, που ήταν σχεδόν χωρίς σκληρότητα.
Με βρασμό το ύδωρ χάνει τη σκληρότητά του.
Άλλωστε στην αντίδραση αυτή οφείλεται ο σχηματισμός των σταλακτιτών (από την οροφή του σπηλαίου) και των σταλαγμιτών (από το δάπεδο).
Οι μεγάλες όμως βιομηχανίες δεν μπορούσαν να καλυφθούν με τις μεθόδους αυτές αποσκλήρυνσης του ύδατος. Εδώ και πολλά έτη χρησιμοποιείται η μέθοδος αποσκλήρυνσης με περμουτίτες. Οι περμουτίτες είναι τεχνητοί ζεόλιθοι (ένυδρα πολυπυριτικο - αργιλικά άλατα αλκαλίων, όπως π.χ. ο νατρόλιθος).
Το σκληρό ύδωρ αφήνεται να κατέλθει από ένα στενό πύργο πλήρη με κόκκους περμουτίτη, οπότε τα κατιόντα του ασβεστίου και του μαγνησίου που περιέχονται στο σκληρό νερό ανταλλάσσονται με ισοδύναμη ποσότητα κατιόντων νατρίου από το ζεόλιθο, ενώ τα ανιόντα παραμένουν στο ύδωρ.
Η ανταλλαγή αυτή είναι αμφίδρομη, και όταν εξαντληθεί ο ζεόλιθος, δηλ. όταν όλο το νάτριο αντικατασταθεί από ασβέστιο και μαγνήσιο, τότε διαβιβάζεται από τον πύργο διάλυμα χλωριούχου νατρίου, το οποίο εκτοπίζει το ασβέστιο ή το μαγνήσιο που είναι ενωμένο με το ζεόλιθο και έτσι "αναγεννάται" ο ζεόλιθος.
Πλέον σύγχρονη μέθοδος αποσκλήρυνσης του νερού είναι η μέθοδος με ανταλλαγή ιόντων. Κατά τη μέθοδο αυτή είναι δυνατό να αφαιρούνται και τα θετικά και τα αρνητικά ιόντα με χρησιμοποίηση κατάλληλων συνθετικών ρητινών από γιγαντιαία οργανικά μόρια. Το ύδωρ αυτό χρησιμοποιείται ως απεσταγμένο.
Ιαματικές πηγές[]
Το ύδωρ της βροχής μερικές φορές διεισδύει μέσα στο έδαφος και γίνεται θερμότερο, για αυτόν το λόγο διαλύει περισσότερες στερεές ουσίες με τις οποίες έρχεται σε επαφή. Το ύδωρ αυτό αναδύεται στην επιφάνεια και σχηματίζει πηγές που λέγονται "θερμές πηγές" ή "μεταλλικές" ή "ιαματικές".
Ανάλογα με τις ουσίες που είναι διαλυμένες στο νερό, οι θερμές πηγές διακρίνονται σε διάφορες κατηγορίες, όπως σε
- "οξυανθρακικές" (Νιγρίτα, Σουρωτή), που περιέχουν διοξείδιο του άνθρακα,
- "θειούχες" ( Λαγκαδάς, Σέδες, Σιδηρόκαστρο), που περιέχουν υδρόθειο και άλλα θειούχα άλατα,
- "αλκαλικές" (Λουτράκι, Αιδηψός), που περιέχουν όξινο ανθρακικό νάτριο ή λίθιο, "πικρές", που περιέχουν θειϊκό μαγνήσιο, θειϊκό νάτριο,
- "σιδηρούχες" και τέλος
- "ραδιενεργές", λόγω των ραδιενεργών αερίων που περιέχουν.
Οι Ιαματικές πηγές εμφανίστηκαν για πρώτη φορά στην πόλη Σπα του Βελγίου.
Πόσιμο Ύδωρ[]
Το πόσιμο ύδωρ πρέπει να είναι διαυγές, άχρωμο, άοσμο, δροσερό (θερμοκρασίας 7 - 11 βαθμών Κελσίου). Πρέπει να περιέχει μικρή ποσότητα ανόργανων αλάτων (0,5 γραμ. στο λίτρο), γιατί το καθαρό νερό χωρίς διαλυμένα άλατα είναι βλαβερό για τον οργανισμό, εξαιτίας της μεγάλης διαπιδυτότητας των κυττάρων. Γι' αυτόν ακριβώς το λόγο τα θαλασσινά ψάρια πεθαίνουν όταν μεταφερθούν σε γλυκό νερό και ψάρια του γλυκού νερού πεθαίνουν αμέσως μόλις τοποθετηθούν μέσα σε απεσταγμένο νερό, επειδή καταστρέφονται τα ερυθρά αιμοσφαίρια (αιμόλυση). Το πόσιμο νερό περιέχει διαλυμένο οξυγόνο, άζωτο, διοξείδιο του άνθρακα, ελάχιστα ίχνη οργανικών ουσιών, καθώς και ίχνη φυτικών μικροοργανισμών.
Γλυκύ Ύδωρ[]
Με το όρο γλυκό ύδωρ χαρακτηρίζεται σε αντίθεση προς τη θάλασσα κάθε υδάτινη έκταση με γλυκό ύδωρ π.χ. λίμνες, ποταμοί. Για την περίπτωση αυτή έχει ορισθεί ειδική γραμμή φόρτωσης πλοίου (μέγιστου δυνατού φορτίου) που ονομάζεται γραμμή φόρτωσης γλυκέων υδάτων (fresh water line). Επίσης στα πλοία, χαρακτηρίζεται γλυκό νερό το ύδωρ που τοποθετείται στις δεξαμενές γκυκέου ύδατος (fresh water tanks) για διάφορες χρήσεις.
Έλεγχος του πόσιμου ύδατος[]
Το πόσιμο ύδωρ πρέπει να εξετάζεται
- φυσικά (θερμοκρασία, διαύγεια, γεύση, οσμή),
- χημικά (ποιοτικός και ποσοτικός έλεγχος ουσιών, σκληρομετρία),
- μικροσκοπικά (έρευνα ύπαρξης μικροοργανισμών),
- βακτηριολογικά (καλλιέργεια των μικροβίων του) και
- τοπογραφικά (θέση πηγής, διαδρομής του).
Τιμή[]
- Από το 1992, η 22η Μαρτίου κάθε έτους έχει καθιερωθεί από τη Γενική Συνέλευση του Οργανισμού Ηνωμένων Εθνών ως η παγκόσμια ημέρα για το ύδωρ.
Υποσημειώσεις[]
Εσωτερική Αρθρογραφία[]
- ενυδάτωση, αφυδάτωση
- οξυγόνο
- υδρογόνο
- Υδρατμός
- πάγος
- υδροφοβικότητα, παγοφοβικότητα
Βιβλιογραφία[]
Ιστογραφία[]
- Ομώνυμο άρθρο στην Βικιπαίδεια
- Ομώνυμο άρθρο στην Livepedia
- physiclessons.blogspot.gr
- Φίλτρα Νερού - Κατάλογος Ελλάδας
- Η κβαντική παραξενιά του νερού
|
Αν και θα βρείτε εξακριβωμένες πληροφορίες "Οι πληροφορίες αυτές μπορεί πρόσφατα Πρέπει να λάβετε υπ' όψη ότι Επίσης, |
- Μην κάνετε χρήση του περιεχομένου της παρούσας εγκυκλοπαίδειας
αν διαφωνείτε με όσα αναγράφονται σε αυτήν
- Όχι, στις διαφημίσεις που περιέχουν απαράδεκτο περιεχόμενο (άσεμνες εικόνες, ροζ αγγελίες κλπ.)