Πυρήν

Μόριο Άτομο Ατομικός Πυρήνας
Σωματίδια Θεμελιώδη Σωματίδια Στοιχειώδη Σωματίδια
Βοσόνιο (boson) Φερμιόνιο (fermion)
Μικρόκοσμος
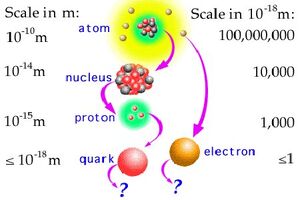
Ο πυρήνας ενός ατόμου είναι μία μικρή περιοχή με μεγάλη πυκνότητα που βρίσκεται στο κέντρο του.
Ετυμολογία
Η λέξη "Πυρήνας" σχετίζεται ετυμολογικά με την λέξη " ".
Εισαγωγή
Ο πυρήνας αποτελείται από θετικά φορτισμένα πρωτόνια και ηλεκτρικά ουδέτερα νετρόνια.
Ο πυρήνας μαζί με το νέφος των ηλεκτρονίων που περιφέρονται γύρω του σχηματίζουν το άτομο.
Όταν ένα άτομο είναι ηλεκτρικά ουδέτερο (δηλ. δεν είναι ιόν) τότε ο αριθμός των ηλεκτρονίων του είναι ίσος με τον αριθμό των πρωτονίων του πυρήνα.
Το μέγεθος του πυρήνα είναι πολύ μικρότερο (περιπου 10.000 φορές) από το μέγεθος του ατόμου, αλλά σχεδόν όλη η μάζα του ατόμου είναι συγκεντρωμένη στον πυρήνα, καθώς τα ηλεκτρόνια είναι πολύ πιο ελαφριά από τα πρωτόνια και τα νετρόνια (περίπου 1.800 φορές).
Οι πυρήνες δεν συμμετέχουν ενεργά στις χημικές αντιδράσεις, οι οποίες καθορίζονται από τα ηλεκτρόνια, εν τούτοις, η έλξη των ηλεκτρονίων από τους πυρήνες των ατόμων παίζει καταλυτικό ρόλο στην πραγματοποίησή τους. Πέραν τούτου, υπάρχουν άλλου είδους αντιδράσεις οι οποίες αλλάζουν την κατάσταση των πυρήνων, γνωστές ως πυρηνικές αντιδράσεις.
Σύσταση
Οι ατομικοί πυρήνες αποτελούνται από πρώτόνια και νετρόνια, τα οποία με τη σειρά τους αποτελούνται από τα υποατομικά θεμελιώδη σωματίδια γνωστά ως κυρκόνια (quarks).
Ισότοπα
Ο αριθμός των πρωτονίων στον πυρήνα κάθε ατόμου καθορίζει το Χημικό Στοιχείο στο οποίο ανήκει το άτομο (π.χ. υδρογόνο, οξυγόνο, κτλ.). Ο αριθμός των νετρονίων καθορίζει το ισότοπο του στοιχείου.
Π.χ. ο συνήθης πυρήνας του οξυγόνου αποτελείται απο 8 πρωτόνια και 8 νετρόνια. Υπάρχουν όμως στη Φύση και πυρήνες οξυγόνου με 8 πρωτόνια και 7 νετρόνια. Πρόκειται για 2 διαφορετικά ισότοπα του οξυγόνου, που ονομάζονται οξυγόνο-16 και οξυγόνο-15 αντίστοιχα.
Τα διαφορετικά ισότοπα ενός στοιχείου έχουν παρόμοιες χημικές ιδιότητες, καθώς οι χημικές αντιδράσεις καθορίζονται από τα ηλεκτρόνια.
Υποσημειώσεις
Εσωτερική Αρθρογραφία
Βιβλιογραφία
Ιστογραφία
|
Αν και θα βρείτε εξακριβωμένες πληροφορίες "Οι πληροφορίες αυτές μπορεί πρόσφατα Πρέπει να λάβετε υπ' όψη ότι Επίσης, |
- Μην κάνετε χρήση του περιεχομένου της παρούσας εγκυκλοπαίδειας
αν διαφωνείτε με όσα αναγράφονται σε αυτήν
- Όχι, στις διαφημίσεις που περιέχουν απαράδεκτο περιεχόμενο (άσεμνες εικόνες, ροζ αγγελίες κλπ.)