Εντροπία


διάβρωση

Θουκυδίδης
Εντροπία
Ευταξία
Αταξία



Εντροπία
Πολυπλοκότητα
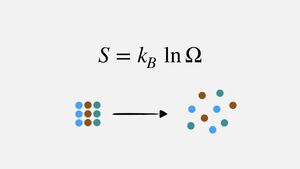
Πείραμα Απειλούμενου Σκύλου
Θεϊσμός

Αταξία
Εντροπία
Μοναρχία
Αναρχία
εντροπία
αφανισμός


Γήρας
- Ένα Εκτατικό Φυσικό Μέγεθος ενός θερμοδυναμικού συστήματος.
Εισαγωγή[]
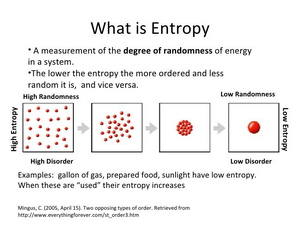
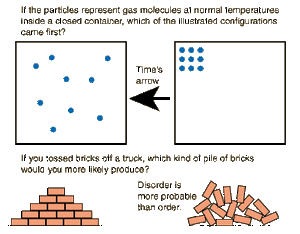
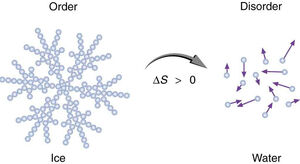
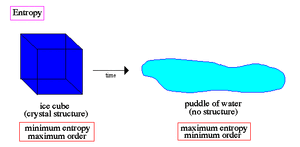
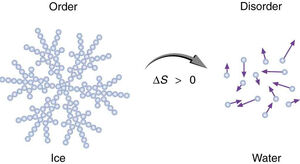
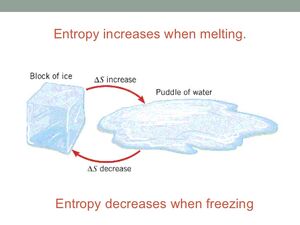
Η έννοια της εντροπίας είναι μία από τις σημαντικότερες έννοιες στις φυσικές επιστήμες, λόγω της διατύπωσης του Δεύτερου Θερμοδυναμικού Αξιώματος, σύμφωνα με το οποίο σε μία μεταβολή ενός απομονωμένου συστήματος η εντροπία αυξάνεται πάντοτε. Θεωρείται ότι εκφράζει την αταξία ενός συστήματος
Ορισμός[]
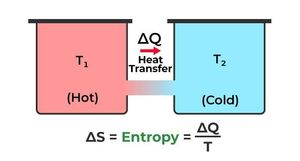
Η απειροστή μεταβολή της εντροπίας προκύπτει από το Πρώτο Θερμοδυναμικό Αξίωμα (ή ορίζεται, αναλόγως ποια διατύπωση της Θερμοδυναμικής ακολουθείται) στη Θερμοδυναμική ως το πηλίκο της απειροστής προσδιδόμενης θερμότητας (σε μια αντιστρεπτή μεταβολή) προς τη θερμοκρασία (δq=Tds). Από αυτό προκύπτει ότι η ροή θερμότητας προς ένα σύστημα έχει ως αποτέλεσμα την αύξηση της εντροπίας του.
Υπολογισμός[]
Η μεταβολή της εντροπίας σε μία μεταβολή μπορεί να υπολογιστεί από το ολοκλήρωμα
(για αντιστρεπτές μεταβολές),
όπου:
cp η Ειδική Θερμοχωρητικότητα υπό σταθερή πίεση και
Τ η θερμοκρασία.
Ο υπολογισμός της μεταβολής της εντροπίας για μη αντιστρεπτές μεταβολές πρέπει να γίνει υπολογίζοντας τη μεταβολή της εντροπίας σε αντιστρεπτές μεταβολές οι οποίες έχουν το ίδιο τελικό αποτέλεσμα με την μη αντιστρεπτή. Αυτό είναι δυνατόν να γίνει, καθώς η εντροπία είναι μια ιδιότητα που εξαρτάται μόνο από την κατάσταση ενός συστήματος.
Με τη χρήση του Τρίτου Θερμοδυναμικού Αξιώματος μπορεί να υπολογιστεί η εντροπία σε οποιαδήποτε θερμοκρασία, γνωρίζοντας την εξάρτηση του cp από τη θερμοκρασία και την ενθαλπία και θερμοκρασία μεταβολής των φάσεων, από τον τύπο:
Tm και Τb είναι οι θερμοκρασίες τήξεως και βρασμού αντίστοιχα και ΔΗm και ΔΗb οι αντίστοιχες ενθαλπίες.
Φυσική Σημασία[]
Είναι αρκετά δύσκολο να δοθεί κάποια φυσική σημασία στην έννοια αυτή, καθώς δεν αντιστοιχεί προς κάποιο αισθητό στον άνθρωπο μέγεθος. Σύμφωνα με την κλασική θερμοδυναμική, εκφράζει τη δυνατότητα ενός συστήματος να παράγει μηχανικό έργο (όσο μικρότερη η εντροπία, τόσο μεγαλύτερη η δυνατότητα του συστήματος να παράγει μηχανικό έργο).
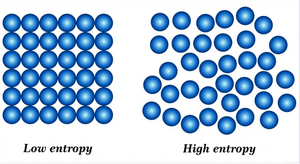
Η φυσική σημασία της εντροπίας μπορεί να θεωρηθεί ότι είναι η έκφραση του μέτρου της αταξίας ενός συστήματος, σύμφωνα με την στατιστική μηχανική.
Από τον Boltzmann προτάθηκε η σχέση
S = klnΩ,
όπου:
- k η σταθερά Boltzmann και
- Ω ο αριθμός των μικροσκοπικών καταστάσεων στις οποιές μπορεί να βρεθεί ένα σύστημα.
Λόγω της διατύπωσης του Δεύτερου Θερμοδυναμικού Αξιώματος, η εννοια της εντροπίας είναι πολύ σημαντική στην κατανόηση της χρονικής ακολουθίας των γεγονότων σε ένα απομονωμένο σύστημα, καθώς κάθε επόμενη κατάσταση του συστήματος θα έχει μεγαλύτερη εντροπία από την προηγούμενη.
Οι διάφορες όψεις της Εντροπίας[]
Η Θερμοδυναμική Εντροπία[]
Ο Clausius επινόησε τον όρο εντροπία υπό την εξής έννοια. Είχε παρατηρήσει ότι σε μια ιδανική Αντιστρεπτή Μεταβολή, υπό σταθερή θερμοκρασία, το πηλίκο της θερμότητας που ανταλλάσσει το Θερμοδυναμικό Σύστημα με το περιβάλλον του, προς την απόλυτη θερμοκρασία υπό την οποία συμβαίνει η μεταβολή είναι ένα σταθερό μέγεθος.
Συμπέρανε λοιπόν ότι αφού το πηλίκο αυτό ήταν σταθερό, θα έπρεπε να παριστάνει ένα πραγματικό, μετρήσιμο μέγεθος. Το μέγεθος αυτό ονόμασε μεταβολή της εντροπίας. Δεν σημαίνει βέβαια ότι κάθε διατηρούμενο πηλίκο πρέπει να παριστάνει και ένα πραγματικό Φυσικό Μέγεθος. Παρ' όλα αυτά για διάφορους ιστορικούς λόγους ο όρος παρέμεινε στη Φυσική.
Για μια αντιστρεπτή μεταβολή που δεν γίνεται υπό σταθερή θερμοκρασία, η μεταβολή της εντροπίας υπολογίζεται από τη σχέση:
- ΔS = Σ( dQ /T ).
Έκτοτε ο όρος αυτός απέκτησε διάφορες σημασίες, οι οποίες εκ πρώτης όψεως δεν φαίνονται καθόλου ισοδύναμες. Συχνά λόγου χάρη αναφέρεται ο εξής ορισμός της εντροπίας: "Για ένα κλειστό σύστημα, το μέτρο της θερμικής ενέργειας που δεν μπορεί να χρησιμοποιηθεί για να παραχθεί έργο, καλείται εντροπία του συστήματος". Αποτελεί δηλαδή το αντίθετο της διαθέσιμης ενέργειας.
Σήμερα συνηθίζεται να χρησιμοποιούμε τον όρο εντροπία σε συνδυασμό με τον δεύτερο Θερμοδυναμικό Νόμο. Αφού λοιπόν η εντροπία δηλώνει την μη διαθέσιμη ενέργεια ενός συστήματος, η έκφραση του Δεύτερου Νόμου που αναφέρει "ότι σε ένα Κλειστό Σύστημα η διαθέσιμη ενέργεια δεν μπορεί να αυξάνει" είναι ισοδύναμη με εκείνη που δηλώνει
"ότι η εντροπία ενός κλειστού συστήματος δεν μπορεί ποτέ να μειώνεται".
Μια άλλη μαθηματικοποιημένη μορφή του δεύτερου θερμοδυναμικού νόμου λέει ότι το στοιχειώδες ποσό θερμότητας που ανταλλάσσει ένα σύστημα κατά τη διάρκεια μιας μεταβολής, η οποία γίνεται υπό σταθερή θερμοκρασία Τ, συνδέεται με τη μεταβολή ενός μεγέθους που ονομάζεται εντροπία, με τη σχέση:
- dQ =< S dT
Η Πληροφορική Εντροπία[]
Το φυσικό μέγεθος "Εντροπία" χρησιμοποιείται για να δηλώσει επίσης το μέτρο της αποδιοργάνωσης ή της αταξίας ή της τυχαιότητας σε ένα σύστημα. Και πάλι έχει μια αρνητική σημασία. Είναι τώρα το αντίθετο της τάξης και της οργανωμένης διάταξης. Την σημασία αυτή στη λέξη, έδωσε ο μεγάλος Αυστριακός φυσικός Ludwig Boltzmann.
Στην εποχή του Boltzmann μια αντίρρηση για την ισχύ του Δεύτερου Θερμοδυναμικού Νόμου ήταν ότι έμοιαζε να επιβάλλει στη Φύση μια προτιμητέα κατεύθυνση στο Χρόνο. Σύμφωνα με τον Δεύτερο Θερμοδυναμικό Νόμο τα φαινόμενα εξελίσσονται μόνο προς μία κατεύθυνση, εκείνη που συνοδεύεται από αύξηση της εντροπίας. Κάτι τέτοιο έρχεται φαινομενικά σε αντίθεση με τους νόμους της Φυσικής σε μοριακό επίπεδο, όπου δεν υπάρχει προτιμητέα κατεύθυνση στο χρόνο. Μια ελαστική κρούση μεταξύ μορίων φαίνεται η ίδια είτε εξελίσσεται προς τα εμπρός είτε προς τα πίσω στον χρόνο. Στις δεκαετίες του 1880 και 1890 ο Boltzmann χρησιμοποίησε το μοριακό πρότυπο των αερίων μαζί με τους νόμους των πιθανοτήτων για να δείξει ότι δεν υπάρχει πραγματική αντίθεση. Το μοντέλο του αποδείκνυε ότι ένα ποσό θερμότητας, αδιάφορο πως είχε εισαχθεί σε ένα αέριο, σύντομα θα διασκορπιζόταν ομοιόμορφα σε όλο το αέριο, όπως προέβλεπε ο Δεύτερος Θερμοδυναμικός Νόμος.
Το μοντέλο μπορούσε επίσης να χρησιμοποιηθεί για να δείξει ότι δύο διαφορετικά αέρια θα αναμειγνύονταν σύντομα ομοιόμορφα αν έρχονταν σε επαφή. Το σκεπτικό που εφάρμοσε για την περίπτωση αυτή ήταν όμοιο με αυτό για την διάχυση της θερμότητας.
Υπάρχει όμως εδώ μια σημαντική διαφορά. Στην διάχυση της θερμότητας, η αύξηση της εντροπίας μπορεί να μετρηθεί με φυσικές μονάδες, δηλαδή Joule ανά grad. Στην περίπτωση ανάμιξης δύο ειδών αερίου που βρίσκονται ήδη στην ίδια θερμοκρασία, αν δεν εισαχθεί στο σύστημα κανένα ποσό θερμότητας, η θερμοδυναμική εντροπία (Joule /grad) δεν παίζει κανένα ρόλο. Η διαδικασία της ανάμιξης σχετίζεται με την διάχυση της θερμότητας, μόνο κατ' αναλογίαν. Παρ' όλα αυτά ο Boltzmann χρησιμοποίησε ένα παράγοντα, που σήμερα τον λέμε σταθερά Boltzmann, για να αποδώσει φυσικές μονάδες και στην περίπτωση της ανάμιξης των αερίων. Έτσι τώρα ο όρος εντροπία εφαρμόζεται επίσης και σε μηχανικές διαδικασίες ανάμιξης. ( Η σταθερά του Boltzmann έχει φυσικά μια συγκεκριμένη φυσική σημασία. Συσχετίζει την μέση Kινητική Eνέργεια ενός μορίου με την θερμοκρασία του αερίου στο οποίο ανήκει το μόριο).
Η λέξη εντροπία με την σημασία αυτή, χρησιμοποιείται επίσης στην εποχή μας, στην επιστήμη της Πληροφορικής, στην Επιστήμη των Υπολογιστών, στη θεωρία των Επικοινωνιών και αλλού. Μια ιστορία αναφέρει ότι στο τέλος της δεκαετίας του 1940, ο John von Neumann, ένας πρωτοπόρος της επιστήμης των υπολογιστών, συνεβούλευσε τον θεωρητικό των επικοινωνιών Claude E. Shannon να αρχίσει να χρησιμοποιεί τον όρο εντροπία όταν αναφέρεται στην πληροφορία διότι "...κανείς δεν καταλαβαίνει τι είναι πραγματικά η εντροπία, κι έτσι σε μια συζήτηση θα έχεις πάντα το πλεονέκτημα...".
Εντροπία κατά Feynman[]
Ο Richard Feynman ήξερε ότι υπάρχει διαφορά μεταξύ των δύο εννοιών της εντροπίας. Στο κεφάλαιο "Εντροπία" του βιβλίου του Lectures on Physics συζητάει την θερμοδυναμική εντροπία χρησιμοποιώντας φυσικές μονάδες, joules ανά βαθμό, και πλήθος μαθηματικών εξισώσεων (τόμος I κεφ. 44-6). Συζητά επίσης τη δεύτερη έννοια της εντροπίας στο κεφάλαιο με τίτλο "Τάξη και Εντροπία" (τόμος I κεφ. 46-5) ως εξής:
"Έτσι τώρα πρέπει να μιλήσουμε για το τι εννοούμε ως αταξία και τι ως τάξη....Υποθέστε ότι διαμοιράζουμε το χώρο σε μικρές στοιχειώδεις περιοχές. Αν είχαμε μαύρα και άσπρα μόρια, κατά πόσους τρόπους θα μπορούσαμε να κατανείμουμε τα μόρια στις περιοχές αυτές έτσι ώστε μαύρο μόριο να βρίσκεται στη μια άκρη και άσπρο στην άλλη; Από την άλλη μεριά, κατά πόσους τρόπους θα μπορούσαμε να τα μοιράσουμε χωρίς να βάλουμε κανέναν περιορισμό για το ποιο πηγαίνει που; Προφανώς υπάρχουν πολλοί περισσότεροι τρόποι για τον δεύτερο τρόπο κατανομής. Μετράμε την "αταξία" με τον αριθμό των τρόπων κατά τους οποίους μπορούμε να τακτοποιήσουμε το εσωτερικό ώστε εξωτερικά να φαίνονται όμοιοι. Ο λογάριθμος αυτού του αριθμού των τρόπων είναι η εντροπία. Ο αριθμός των τρόπων όταν βάλουμε τον περιορισμό να υπάρχει συγκεκριμένο χρώμα στις άκρες, είναι μικρότερος, κι έτσι η εντροπία είναι μικρότερη, και η αταξία επίσης μικρότερη."
Αυτό είναι πάλι το μοντέλο του Boltzmann. Σημειώστε ότι ο Feynman δεν χρησιμοποιεί την σταθερά του Boltzmann. Δεν αποδίδει επίσης φυσικές μονάδες σε αυτό το είδος της εντροπίας. Απλώς πρόκειται για έναν αριθμό. Ένας λογάριθμος είναι ένας αριθμός χωρίς φυσικές μονάδες. Ο Feynman δεν χρησιμοποιεί επίσης ούτε μια εξίσωση σε αυτό το κεφάλαιο του βιβλίου του.
Σημειώστε επίσης και κάτι άλλο. "Ο αριθμός των τρόπων" μπορεί να μετρηθεί μόνο όταν αρχικά έχει διαιρεθεί ο χώρος σε μικρά στοιχειώδη τμήματα. Το σημείο αυτό δεν είναι καθόλου μικρής σημασίας. Σε κάθε φυσική πραγματική κατάσταση, η μέτρηση του αριθμού των δυνατών διατάξεων απαιτεί μια αρχική κατάτμηση του χώρου. Όπως λένε οι Peter Coveney και Roger Highfield
"Δεν υπάρχει ωστόσο τίποτα που να μας λέει πόσο μικρή πρέπει να είναι η διαμέριση του χώρου. Οι εντροπίες που υπολογίζονται με τον τρόπο αυτόν εξαρτώνται από την κλίμακα μεγέθους της διαμέρισης, σε αντίθεση με την θερμοδυναμική όπου οι μεταβολές της εντροπίας είναι αντικειμενικές."
Εντροπία κατά Shannon[]
Ο ίδιος ο Claude Shannon φαίνεται να είναι γνώστης αυτής της διαφοράς στην περίφημη εργασία του του 1948, "Μια Μαθηματική Θεωρία της Επικοινωνίας." Γράφει λοιπόν για το θέμα της διαμέρισης, "Στην περίπτωση του συνεχούς μέσου η μέτρηση εξαρτάται από το σύστημα συντεταγμένων. Αν αλλάξουμε συντεταγμένες, θα αλλάξει γενικά και η εντροπία". Στην ίδια εργασία δεν αποδίδει καθόλου φυσικές μονάδες στην εντροπία και δεν αναφέρει πουθενά τη σταθερά του Boltzmann (k). Σε κάποιο σημείο μόνον, εισάγει εν συντομία τη σταθερά k λέγοντας : "Η σταθερά k απλώς ρυθμίζει θέματα επιλογής των μονάδων μέτρησης ". Ο Shannon ποτέ δεν προσδιορίζει την μονάδα μέτρησης και πουθενά στην 55σέλιδη εργασία του δεν εμφανίζεται ξανά η σταθερά k, εκτός από το παράρτημα στο τέλος.
Το είδος αυτό της εντροπίας είναι προφανώς διαφορετικό. Δεν συνοδεύεται από φυσικές μονάδες και (εκτός από την περίπτωση της ψηφιακής επικοινωνίας), μια αυθαίρετη σύμβαση πρέπει να επιβληθεί πριν αρχίσουμε να μιλάμε ποσοτικά για αυτήν. Για να διακρίνουμε αυτό το είδος της εντροπίας από την θερμοδυναμική εντροπία, θα την αποκαλέσουμε λογική εντροπία.
Παρά την σημαντική διαφορά μεταξύ των δύο ειδών εντροπίας, ο κανόνας που διατυπώθηκε παραπάνω για την θερμοδυναμική εντροπία φαίνεται να ισχύει και για την λογική εντροπία. Η εντροπία δηλαδή ενός κλειστού συστήματος δεν μπορεί ποτέ να ελαττώνεται. Και πραγματικά δεν υπάρχει τίποτα μυστηριώδες σχετικά με αυτόν τον κανόνα. Είναι ισοδύναμη με την φράση "ότι τα πράγματα δεν οργανώνονται ποτέ από μόνα τους".
Είναι αλήθεια ότι κρύσταλλοι και άλλοι κανονικοί σχηματισμοί μπορούν να σχηματιστούν από μη καθοδηγούμενες διαδικασίες. Και έχουμε συνηθίσει να λέμε ότι αυτοί οι σχηματισμοί είναι "οργανωμένοι". Φυσικά αυτό δεν σημαίνει ότι αναπτύσσουν κάποια όργανα. Η πιο σωστή λέξη βέβαια για τους κανονικούς αυτούς σχηματισμούς είναι "διατεταγμένοι" αντί για "οργανωμένοι". Η μορφή ενός κρυστάλλου είναι ήδη παρούσα μέσα στο διάλυμα από το οποίο αναπτύσσεται. Το κρυσταλλικό πλέγμα περιγράφεται από τη δομή των μορίων που το αποτελούν. Ο σχηματισμός των κρυστάλλων είναι το απευθείας αποτέλεσμα χημικών και φυσικών νόμων, που δεν εξελίσσονται και οι οποίοι συγκρινόμενοι με τα γενετικά προγράμματα είναι πολύ απλοί.
Ο κανόνας ότι τα πράγματα ποτέ δεν οργανώνονται από μόνα τους ισχύει επίσης και στην καθημερινή μας εμπειρία. Ένα σπασμένο γυαλί δεν κολλάει από μόνο του αν δεν το επιδιορθώσει κάποιος. Χωρίς συντήρηση ένα σπίτι χειροτερεύει. Χωρίς διοίκηση μια επιχείρηση αποτυγχάνει. Χωρίς καινούργιο λογισμικό ένας υπολογιστής δεν αποκτά ποτέ νέες δυνατότητες. Ποτέ!
Η εντροπία κατά Darwin[]
Ο Charles Darwin είχε καταλάβει πολύ καλά αυτή την παγκόσμια αρχή. Οπότε προειδοποιούσε τους βιολόγους να μην αποκαλούν τα μεταγενέστερα εξελικτικά στάδια "ανώτερα". (Παρόλα αυτά η λέξη "ανώτερα" με αυτήν την απαγορευμένη σημασία, εμφανίζεται αρκετές φορές στην πρώτη έκδοση του έργου του Δαρβίνου: "Η Καταγωγή των ειδών.")
Ακόμη και σήμερα αν ισχυριστούμε ότι ένας άνθρωπος είναι περισσότερο εξελιγμένος από ένα σκουλήκι ή μια αμοιβάδα, θα υπάρξουν Νεοδαρβινιστές που θα εναντιωθούν σε αυτή τη θέση. Υιοθετούν τη θέση ότι, η εξέλιξη δεν δείχνει αναγκαστικά μια τάση προς υψηλότερα οργανωμένες μορφές ζωής. Ισχυρίζονται ότι πρόκειται απλά για διαφορετικές μορφές.
Τέτοιους ισχυρισμούς βρίσκουμε στα παρακάτω έργα:
- Όλα τα απομακρυσμένα μεταξύ τους είδη είναι εξίσου εξελιγμένα. — Lynn Margulis και Dorion Sagan, 1995
- Δεν υπάρχει πρόοδος στην εξέλιξη. — Stephen Jay Gould, 1995
- Όλοι συμφωνούμε πως δεν υπάρχει πρόοδος. — Richard Dawkins, 1995
- Η Ουτοπία της προόδου — John Maynard Smith και Eörs Szathmáry, 1995
Η θέση αυτή όμως αγνοεί απλά δεδομένα της ζωής και της εξέλιξης.
Υποσημειώσεις[]
Εσωτερική Αρθρογραφία[]
- αρνηντροπία [( = negentropy)
- Δίλημμα Όνου Buridan
- 2ο Θερμοδυναμικό Αξίωμα
- Θερμοδυναμικό Σύστημα
- Εντροπική Βαρύτητα
- Εντροπία Μελανής Οπής
- Διεμπλεκόμενη Εντροπία (Entropy of entanglement
Βιβλιογραφία[]
- Κατσάνου, Ν.Α., Φυσικοχημεία, Τρίτη Έκδοση Συμπληρωμένη, Εκδόσεις Παπαζήση, Αθήνα 1993, ISBN 960-02-0448-9
- Smith, J.M., Van Ness, H.C., Abbott, M.M., Εισαγωγή στη Θερμοδυναμική (μετάφραση Σοφία Κ. Πολυματίδου), 5η έκδοση, Εκδόσεις Τζιόλα, Θεσσαλονίκη, ISBN 960-7219-79-1
Ιστογραφία[]
- Ομώνυμο άρθρο στην Βικιπαίδεια
- Ομώνυμο άρθρο στην Livepedia
- Ομώνυμο άρθρο στην Astronomia
- [ http://www.physics4u.gr/articles/2002/secondlaw2.html Εκτενής αναφορά στο Physics 4u]
- [ ]
|
Αν και θα βρείτε εξακριβωμένες πληροφορίες "Οι πληροφορίες αυτές μπορεί πρόσφατα Πρέπει να λάβετε υπ' όψη ότι Επίσης, |
- Μην κάνετε χρήση του περιεχομένου της παρούσας εγκυκλοπαίδειας
αν διαφωνείτε με όσα αναγράφονται σε αυτήν
- Όχι, στις διαφημίσεις που περιέχουν απαράδεκτο περιεχόμενο (άσεμνες εικόνες, ροζ αγγελίες κλπ.)